私たちの専門知識・チーム医療が対応可能な疾患は糖尿病、肥満症、低血糖症です。
糖尿病
血糖管理を改善するための治療には、食事療法、運動療法そして薬物療法(経口薬療法、インスリン療法(持続性皮下注入療法を含む))があります。
当センターでは、外来と入院でのチーム医療を通じて、皆様の生活スタイルにあった個別化した食事療法、運動療法、薬物療法を経験豊富な各部門の専門スタッフが提供します。また、充実した検査体制で糖尿病合併症の早期発見を目指し、最新のガイドライン*1とエビデンス*2に基づいた治療を行います。
糖尿病の合併症を予防するためには、血糖のみならず血圧、脂質そして体重の管理も重要です。これらの管理についても、血糖管理同様に、一人ひとりの病状にあった治療をご提案します。
【用語説明】
*1ガイドライン:科学的根拠に基づき、病気の予防/診断/治療等の根拠や手順をまとめた指針
*2エビデンス:根拠に基づく医療
治療方針
全人的糖尿病診療:~理想的から1歩前進の治療まで~
糖尿病者が合併症を予防し生涯健康を保つためには血糖管理が必須です。一方で、合併症を予防するためには病院で測定する血糖値やHbA1c値(血糖値の2-3ヶ月間の平均値)だけに着目しても、なかなか満足のいく結果に結びつかない場合が少なくありません。
2018年から欧米糖尿病学会の2型糖尿病血糖管理ガイドライン(最新の科学的証拠や根拠に基づいた診療に関する指針)では、個人中心の全人的診療が推奨されています。
このガイドラインでは:
- 糖尿病者一人ひとりの優先事項(健康/治療を優先するか/しないかなど)、治療への意欲、抑うつや認知の問題、全身状態や併存症、社会的バリアなどの心理的・身体的・社会的な治療決定因子を全人的に理解する。
- 協調的に一人ひとりに適した個別化治療計画を立て、その計画の円滑な実行のための自己管理教育支援を行う。
- 継続的な心理的/社会的サポートと定期的な管理計画の見直を行う。
以上の3つが主な柱となっております。
特に最新のガイドラインでは経済、環境、政治的要因を含む社会的バリアの重要性が強調されている印象です。確かに職場、家庭、社会生活上でのなんからの「生きにくさ」を感じると、治療への気配りが行き届かなくなり、結果として合併症が進行してしまう方を経験します。そのような場合、医療従事者が「理想的な治療」を勧めるだけではなく、ご本人にとって非常に「生きにくい」状況でも実行可能な「一歩前進の治療」を相談する姿勢も必要と考えられます。また、知識不足や誤解、思い込みや友人の勧めなどから余り適切とは思えない自己管理に励んでいる事例も経験します。その際は、医療従事者が客観的にお勧めできそうな情報を適宜解りやすくお伝えする必要もありそうです。
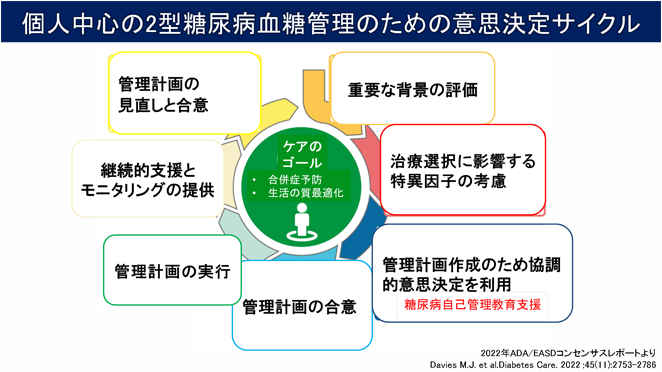
自己管理教育支援
生活習慣の自己管理は軽視されがちで、かつ敬遠されることも多いのが実情です。
経験豊富なスタッフによるチーム医療で、皆様の生活習慣、価値観、人生観など、様々なニーズを把握することに努め、一人ひとりに適した自己管理教育支援を行います。(上図参照)
『個人中心の意思決定サイクル』を実現するには、皆様の同意とご協力が必要不可欠です。また、この取り組みはアンケートなどを通じて定期的に評価し、管理計画の改善に役立ております。
『個人中心の意思決定サイクル』を実現するには、皆様の同意とご協力が必要不可欠です。また、この取り組みはアンケートなどを通じて定期的に評価し、管理計画の改善に役立ております。
食事療法
検査値や症状が個々に異なる様に、誰にでも合うワンパターンな食事療法はありません。また、特定の栄養素や食品を推奨・禁止するようなこともありません。(これを食べればよい、あるいは食べなければ大丈夫など)
管理栄養士を中心に、食生活について聞き取りを行い、食べる時間、回数、バランスに乱れや偏りがないか確認いたします。お聞き取りした内容と検査データをもとに、合併症の予防や生活の質向上・最適化を目標とした『食生活の問題点と改善策』をご提案いたします。
運動療法
運動療法は食事療法と並んで糖尿病治療の基本と言われております。
当センターでは、一人ひとりの体力や生活習慣、合併症の調査を行い安全で効率的な運動療法の実践を目指しております。(下図参照)
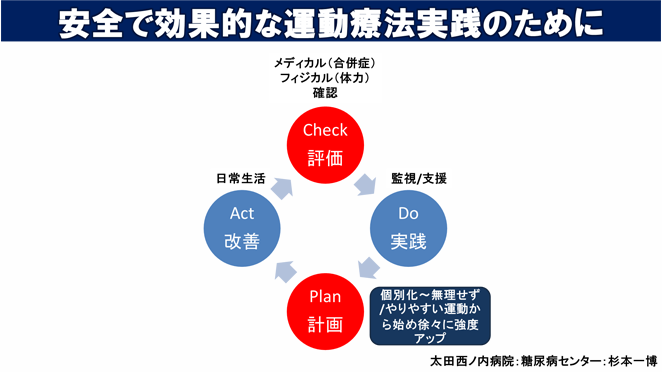
当院の運動指導室は様々な疾患に対応した運動療法を提供していますので、医師による評価、許可があればご希望の方はどなたでも参加出来ます。
また、ご自宅で無理なく継続できるような、日常生活の身体活動量の増加を目標とした計画もご提案いたします。
※運動指導室についは運動指導室のご案内をご覧ください。
※YouTubeに参考動画をアップロードしております。こちらよりご覧ください。
薬物療法
「糖尿病診療の目的」は、皆様の「合併症の抑制」と「生活の質の向上」となります。食事、運動療法と並んで薬物療法を行う目的も、当然この「糖尿病診療の目的」と同じになります。
薬物療法を追加して血糖管理を良好に保つことで、5年~10年先の糖尿病三大合併症(糖尿病性神経障害、網膜症、腎臓病)の発症を減少させることが期待できます。しかし、血糖管理を不良(ヘモグロビンA1c値*3 >8.0~8.5%)のまま放置すると、それより前に三大合併症が進行する場合があり、それぞれ下肢切断、失明、人工透析(腎臓で尿が十分作れなくなる状態)の原因となります。 合併症はいったん進行すると元に戻すことができず、生活の質を大きく下げてしまいますので、予防することがとても大切です。
食事と運動療法だけでは、どうしても目標の血糖管理に到達し維持することが難しいと考えられる場合には薬物療法を提案します。しかし、薬物療法を追加した後も、できるだけ薬物療法の負担を軽くするためには、ご負担の強くない範囲で食事、運動療法の継続が必要です。 治療に占める食事、運動療法の割合が少ないほど、当然薬物療法に頼る割合は増え、薬の副作用の危険性も増える可能性があります。
一方で、適切な薬物療法を行わず、血糖管理不十分不のまま放置すると、前述のように急速に合併症が進み回復が難しくなる場合もありますので、適切な専門的判断が求められます。
【用語説明】
*3ヘモグロビンA1c値:2~3ヶ月間の平均血糖値を反映する値
1型糖尿病症例への薬物療法
基本は強化インスリン療法(食事ごとの血糖値上昇を抑えるインスリンと空腹時の血糖値上昇を抑えるインスリンとを組み合わせて調節する治療)になります。
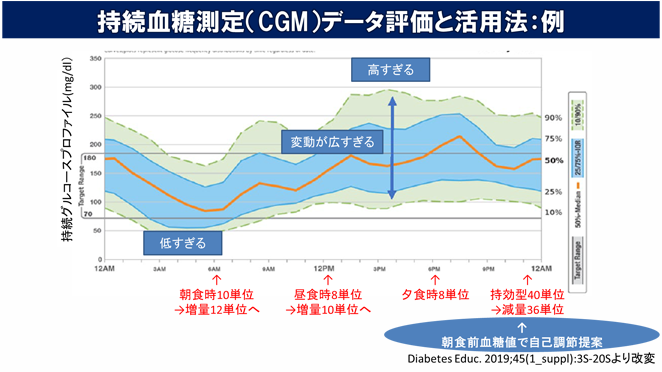
皆様の生活スタイルの違い(食生活や日常の運動量、仕事内容など)を確認しながら、ご希望や必要に応じて血糖変動が確認できる持続血糖測定器(下図参照)も活用して良好な血糖管理を達成できるように支援します。
2型糖尿病症例への薬物療法
薬物療法は生活習慣の自己管理(適切な体重管理と食事/運動療法)への取り組みと共に行い、できるだけ薬物療法に頼らない治療を目指します。この考え方は医療費の節減や合併症を予防して健康を維持ための費用対効果の観点からも有効性が証明されています。
お薬を処方する際の基本方針としては、米国および欧州糖尿病学会の推奨する最新のガイドライン*を参考にしてします。
お薬による副作用防止のためにも、内服薬はできるだけ3剤までに留めることを目指し、一人ひとりに合った、より安全でかつ有効なお薬から処方します。
【用語説明】
*ガイドライン:科学的根拠に基づき、病気の予防/診断/治療等の根拠や手順をまとめた指針
STEP1
薬物療法を始める際には低血糖を増加させない薬剤から選択するのが基本です。
一般的には、60年以上にわたり安全性と有効性が証明されてきたメトホルミンが多くの2型糖尿病者へ最初に処方するお薬(第一選択薬)になります。
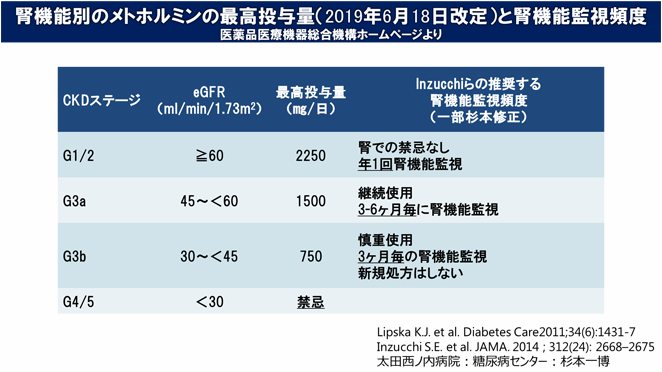
以下にメトホルミン新規処方時のチェックリストを示します。いずれかに該当する場合、メトホルミンによる乳酸アシドーシス発症の危険性があり新規処方は推奨されません。
疑い例などにやむを得ず新規処方する場合、血中乳酸値を定期的に測定し高乳酸血症(例:≧2.5mmol/L(22.5mg/dl))を認める場合は適宜減量~中止する必要があります。
メトホルミンは少量(1日500mg)から開始して、下表の腎機能に応じた1日最高投与量を目安にゆっくり増量します。
また、新規処方時のみならず以下に示す頻度を目安に定期的に腎機能を評価し投与量の調節を行う必要があります。

STEP2
2剤目以降に処方するお薬は、合併症(動脈硬化症、腎臓病、心不全)の有無や副作用・負担に留意して選択します。
お薬の副作用は様々ですが、特に『肥満者の体重増加』、『認知症が懸念される高齢者の低血糖(血糖値が低くなりすぎること)』に留意した処方を行います。
より効果的に血糖管理が行えるようインスリンの体内分泌量を評価しながら、一人ひとりに適したお薬を提案いたします。
※個々の病状により効果や副作用に差がございますので、 詳しい内容やご不明な点などは外来/病棟担当医にご確認ください
※薬物療法の詳しい解説は以下をご参照ください。(主に医療従事者向け)
図1:2型糖尿病者にメトホルミンを第一選択薬とする場合のフローチャート(薬剤の選び方の流れ図)になります。
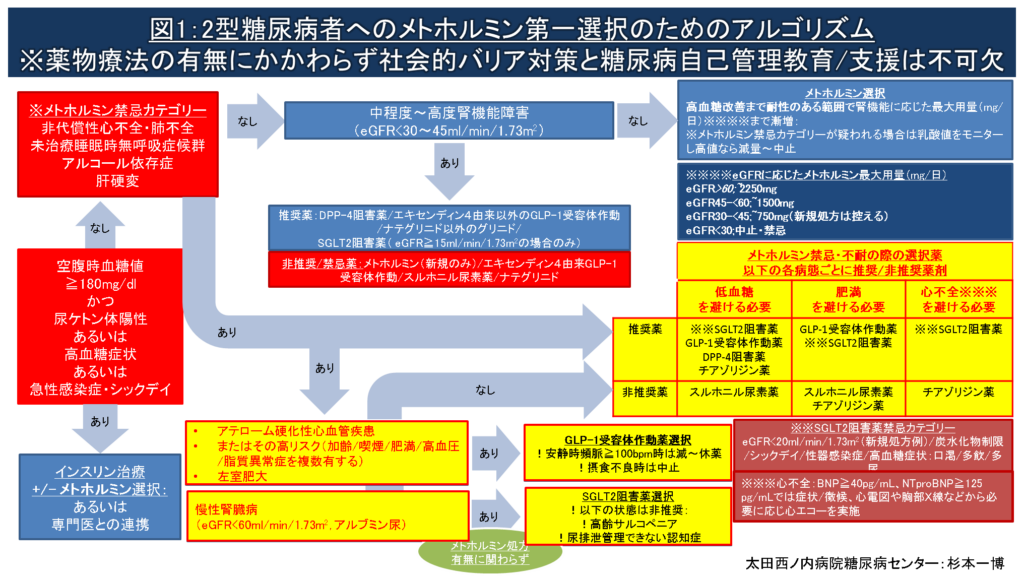
- 実践可能な食事/運動療法を含む糖尿病自己管理教育/支援と社会的バリア対策を行っても空腹時血糖値≧180mg/dlかつ尿ケトン体陽性、高血糖症状(多尿、口渇、多飲、体重減少)、あるいは急性感染症などでシックデイを呈している、またはその状態を脱却困難と判断される場合、高血糖緊急症による救急搬送に至らないよう速やかなインスリン治療の導入または専門医との連携診療が推奨されます。
- 01の高血糖緊急症リスクがない場合、上記の「メトホルミン新規処方時のチェックリスト」を参照して乳酸アシドーシス発症リスクを高める禁忌カテゴリーに該当しないか確認します。
- メトホルミン禁忌カテゴリーに該当せず中程度?高度腎機能障害もない場合、一般に用量依存性に強い高血糖改善作用を有するメトホルミンの優先的処方が推奨されます。メトホルミンの主な副作用である消化器症状の発現を最小限にするため以下のSTEPを参考に少量から漸増します。
【STEP1】
開始法:メトホルミン(250mg)朝夕2回、あるいはメトホルミン(500mg)朝1回(服薬単純化が必要な場合など)から開始
【STEP2】
増量法:入院中は3~5日ほど/外来では2週間~3ヶ月ごと、体格(注)、腎機能や消化器症状(一番多いのは軟便・下痢、心窩部不快感、吐き気など)に応じ、1日量として250mg~500mgずつ漸増
(注)小柄女性では~1000mg/日以下など
漸増法(例):メトホルミン(250mg)朝夕2回→(250mg)朝昼夕3回→(500mg)朝夕2回→(500mg)朝昼夕3回あるいは(750mg)朝夕2回→(1000mg)朝夕2回 - メトホルミンが禁忌/不耐の場合、図1アルゴリズムと以下の解説も参照して薬物療法による利益がリクス/負担をできるだけ大きく上回る(純利益を極大化する)薬剤選択をしてください。
図2:血糖値を下げるインスリンの体内分泌量(Cペプチド)と体格(BMI)を目安にした2型糖尿病者への推奨第二選択薬になります。

GLP-1受容体
メトホルミン高用量に匹敵するA1c降下作用を有するため血糖管理が不十分な症例に処方を検討する製剤です。2021年2月5日から従来の注射製剤に加えて経口薬も処方可能となっています。一番多い有害事象である消化器症状出現、体重減少(肥満例では利益でもあります)、比較的稀ですが胆石症発症リスク増加が許容できる注射製剤への抵抗感が少ない症例に処方します。エキセンディン4由来製剤は腎機能低下(eGFR<30ml/min/1.73m^2)の場合には禁忌となります。心血管疾患既往またはそのリスクの高い症例に利益が大きい可能性があります。
SGLT2阻害薬
ブドウ糖摂取不足時の正常血糖ケトアシドーシス、性器真菌感染症、体重減少、利尿薬処方中の高齢者では体液減少/脱水のリスク増加が許容できる腎機能保持(eGFR≧20ml/min/1.73m^2)症例に処方します。特に、心不全(例:BNP≧40pg/ml又はNT-proBNP≧125pg/ml)や腎症発症/進行リスクの高い症例(例:顕性蛋白尿)に利益が大きい可能性があります。
ピオグリタゾン
肥満、心不全、骨粗しょう症/転倒骨折、膀胱癌発症のリスク増加が許容できるインスリン分泌保持~過剰な症例に処方します。特に、心不全リスクのない脳血管疾患や冠動脈疾患合併症例に利益が大きい可能性があります。
DPP-4阻害薬
類天疱瘡、間質性肺炎と言った非常に稀なリスク増加のみの比較的安全性の高い薬剤ですが、肥満/高インスリン血症患者での血糖降下作用は減弱する可能性があります。一部の薬剤で微量アルブミン尿軽減やスルホニル尿素薬に比し脳卒中の発症リスク軽減が報告されています。一方で、一部の薬剤で心不全リスク増大の報告があり、血糖降下効果以外の明確な心血管合併症や生命予後に対する利益は証明されていません。
図3(1)(2):各薬剤による純利益= 利益-負担/リスク
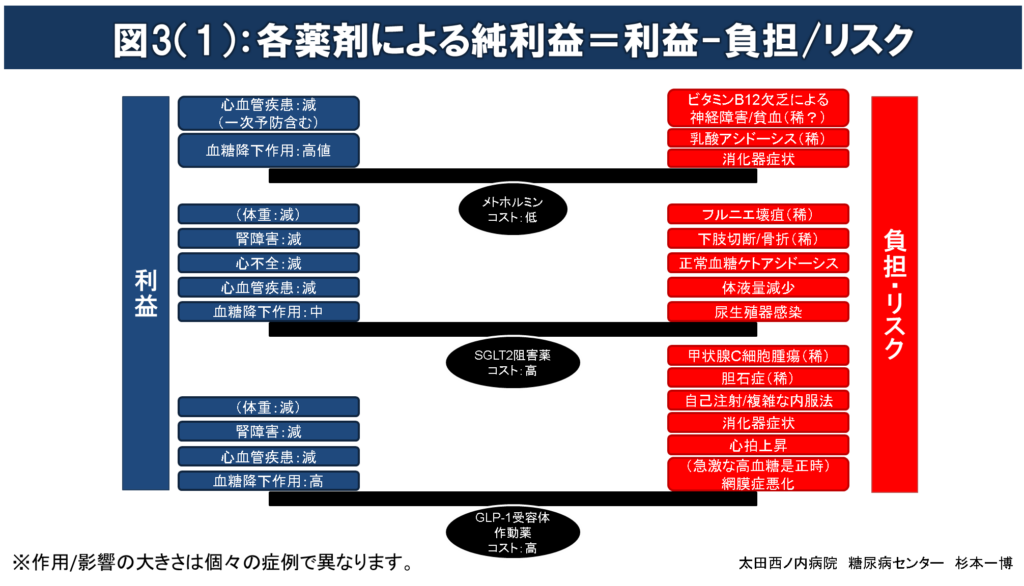
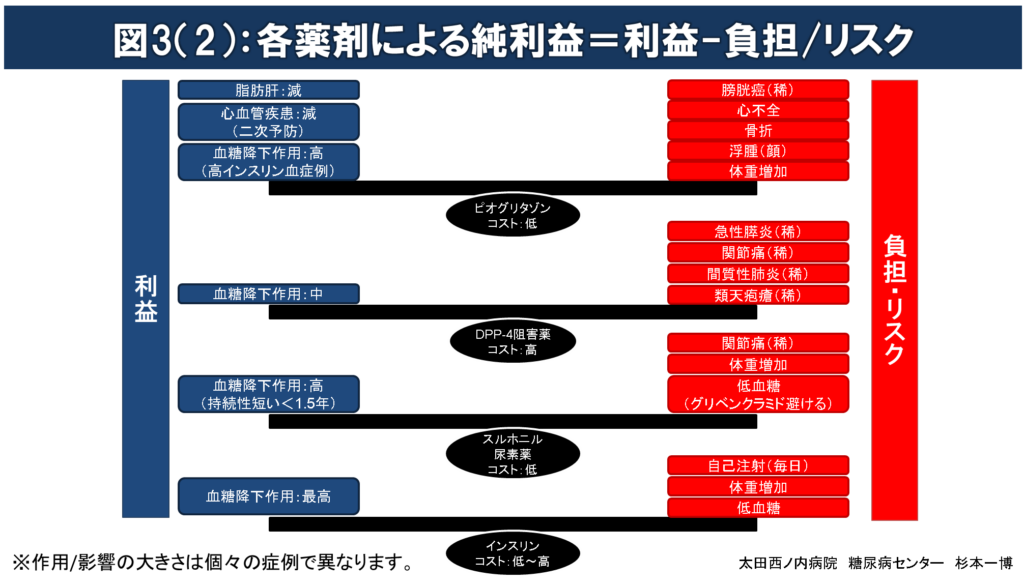
薬物療法を開始する場合には、薬剤投与によってもたらされる得る利益が負担/リスクをできるだけ大きく上回る(純利益(=利益-負担/リスク)の極大化を目指した)薬剤選択を行うのが望ましい。
すべての糖尿病治療薬は血糖降下作用を介して長期間血糖管理を良好に改善させることで、~10年後の糖尿病三大合併症(糖尿病性神経障害、網膜症、腎臓病)の発症/進行を抑制する利益をもたらす。
糖尿病治療薬のなかで、メトホルミン、SGLT2阻害薬、GLP-1受容体作動薬およびピオグリタゾンには、血糖降下作用の他に、心血管疾患、腎障害、心不全、体重のすべて又はそのいくつかへの影響が報告されている。
治療薬投与によるリスク/負担が長期間(~10年)の血糖管理改善による利益を上回るような薬剤選択は行わない。
例:肥満高齢者へのスルホニル尿素薬、腎不全合併者へのメトホルミン投与など。
図4:血糖降下薬選択のための9因子
血糖降下薬選択の際に考慮すべき代表的な因子(1)~(9)を表に示します。
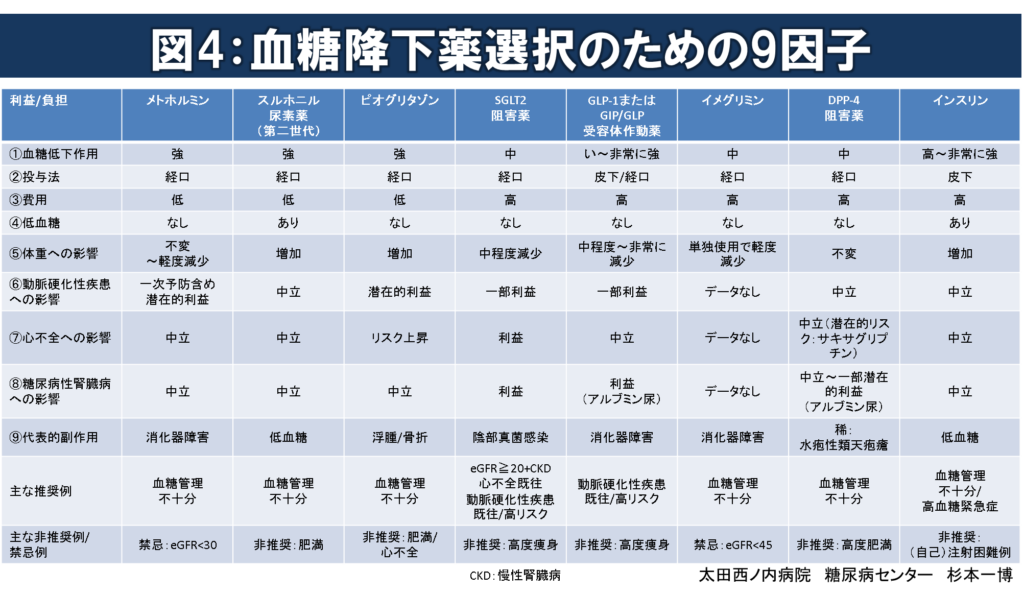
(1)血糖降下作用
日常診療の多くで最も重視される可能性が高いのは、やはり血糖降下作用になります。
同じ薬剤でも個々の病状、内因性インスリン分泌能、インスリン感受性、食事、運動習慣等の影響により作用差が大きいですが、各薬剤の最大用量での作用の強さをHbA1c値の低下度で表すと概ね以下のようになります。
- 非常に強:-2.0~-3.0%
- 強:-1.0~-2.0%
- 中:-0.5~-1.0%
- 弱:-<0.5%※
※高血糖改善を目的に血糖低下作用の弱い(A1c値低下作用<-0.5%)薬剤を優先して選択することは一般に推奨されません。
(注)薬剤投与を開始する際、効果的な食事/運動療法並びに血糖管理に影響する社会的バリアへの対策、自己管理教育支援を行うことでも2%以上のA1c値低下が見込まれることを考慮し過剰治療*とならないようにします。
薬剤投与による有害作用や(薬価含む)負担なく個々の病状に見合った目標A1c値を達成し得る薬剤を初期から単剤、または必要に応じて複数選択します。特に、薬物療法以外の対策(上記注)をとった上でも現状のA1c値が目標値より>1.5~2.0%上回っている場合、非常に強い血糖低下作用を有する一部のGLP-1受容体作動薬またはインスリン以外、単剤での目標達成は困難と判断されるため、初めから複数の薬剤を組み合わせて投与します(例:現状のA1c値13%で目標A1c値<7%の健常成人の場合、メトホルミン+GLP-1受容体作動薬+インスリン併用など)。
一方、血糖管理が改善し目標A1c値を十分下回った際には過剰治療*にならないよう減薬の可能性を考慮します。
*過剰治療:治療による利益<治療によるリスク/負担となる状態。治療強化による利益には上限がある一方、リスク/(薬価含む)負担は増加し続け、ある時点で治療強化による有害事象が利益を上回る可能性があります(例:高齢者に対するインスリン過剰投与の場合、A1c値低下のよる利益<低血糖による認知症悪化/転倒リスクなど)。
(2)投与法
経口と皮下投与があります。海外では吸入インスリンがありますが、日本では処方できません。皮下投与の場合、投与を受ける方の心理的、肉体的、経済的負担の増大に配慮します。また、治療を適切に継続するために必要な自己注射手技教育支援、認知機能評価、家族/社会的支援の確認も行います。
(3)費用
欧米に比べると日本の薬価は数10分の1に抑えられているものの経済的に不安定な状況での薬価負担は治療中断のきっかけにもなり得ます。
(4)低血糖
単剤で低血糖リスクを上昇させるはスルホニル尿素薬とインスリンです。機序はまだ不明ですが単剤では低血糖リスクを上昇させないメトホルミンとイメグリミンの併用でも低血糖発症率が上昇するとの報告があります。
(5)体重への影響
体重管理は血糖、血圧、脂質、心腎血管疾患リスク管理と並んで糖尿病者の予後を決定するため非常に重要です。
- 体重増加作用を有する薬剤:スルホニル尿素、インスリン、ピオグリタゾン
- 体重低下作用を有する薬剤:GIP/GLP-1受容体作動薬、GLP-1受容体作動薬、SGLT2阻害薬
メトホルミンもわずかに体重を低下させる場合があります。
(注)一部のGLP-1受容体作動薬以外、肥満症治療など体重への作用を目的に処方することはできません。
(6)動脈硬化性疾患への影響
動脈硬化性心血管疾患既往またはその高リスク例(例:加齢、高血圧、脂質異常症、喫煙、肥満の危険因子を複数有する例など)において、一部のGLP-1受容体作動薬やSGLT2阻害薬投与と動脈硬化性疾患再発や心血管死亡率減少との関連が報告されています。したがって、このような症例への優先的なGLP-1受容体作動薬やSGLT2阻害薬の選択が推奨されます。ピオグリタゾンも心血管疾患既往例の再発率の低下と関連することが報告されています。メトホルミンは心血管疾患既往の有無にかかわらず、その発症率低下と関連することが報告されています。
(7)心不全への影響
糖尿病合併の有無にかかわらず、一部のSGLT2阻害薬(エンパグリフロジンとダパグリフロジン)は心不全合併例の心不全による入院を減少させる効果が期待できるため心不全への保険適応が認められています。ピオグリタゾンは主な副作用に浮腫があり心不全入院リスクの上昇と関連するため心不全合併例には処方を控えます。メトホルミンは非代償性心不全合併例において乳酸アシドージスを引き起こす可能性があり禁忌ですが、代償性心不全合併例においては死亡率低下と関連しており欧米のガイドラインでは優先的な選択が推奨されています。
(8)糖尿病性腎臓病への影響
糖尿病合併の有無にかかわらず、一部のSGLT2阻害薬(エンパグリフロジンとダパグリフロジン)は慢性腎臓病合併例の腎アウトカム(腎機能の悪化、透析導入、腎死)を減少させる効果が期待できるため慢性腎臓病への保険適応が認められています。一部のGLP-1受容体作動薬やDPP-4阻害薬にはアルブミン尿減少との関連が報告されています。
(9)副作用
表には代表的な副作用のみ記載しています。より詳しい内容は図3を参照してください。
主な推奨例
全ての薬剤が血糖管理不十分な症例に推奨さえ得ますが、個々の病状、病態、血糖管理への選好に適した目標A1c値に到達可能な薬剤を単剤または適宜複数組み合わせて選択するのが理想です。薬物療法による利益が極大化し、副作用リスク/負担が極小化(=純利益の極大化)し得る有効性の高い薬剤の選択とその継続に必要な自己管理教育支援を目指します。多剤併用を避けるためにも十分な血糖降下作用が期待できる薬剤を優先して選択します。
個々の病態(特に内因性インスリン分泌能やインスリン感受性)により作用差がありますので、薬剤選択前に血清Cペプチド値の確認を推奨します。肥満の有無のみを薬剤選択の根拠すると適切な薬剤選択ができません。動脈硬化性疾患既往/高リスク例では一部のGLP-1受容体作動薬とSGLT2阻害薬、心不全/慢性腎臓病合併例では一部のSGLT2阻害薬の優先的選択が推奨されます。高血糖緊急症またはその高リスク例(尿ケトン体陽性)では速やかなインスリン治療の導入が推奨されます。
メトホルミンは個々の内因性インスリン分泌能やインスリン感受性の影響を比較的受けず①用量依存性に強い血糖低下作用、②経口投与、③低い薬価負担、④単剤で低血糖リスクなし、⑤体重への影響僅か、⑥心血管疾患発症率低下と関連性、⑦代償性心不全例での死亡率低下と関連性を示し薬物療法による純利益の極大化に貢献し得るため第一選択薬の候補となります。
主な非推奨例/禁忌例
血糖管理のみならず体重管理と心腎血管疾患リスク管理は糖尿病診療の重要な柱となります。
肥満(BMI≧25 kg/m2)例に体重増加作用を有するスルホニル尿素およびピオグリタゾンの処方は推奨されません。逆に、高度痩身(例:BMI<18kg/m2)例に体重低下作用のあるSGLT2阻害薬およびGLP-1受容体作動薬の処方も注意が必要です。また、DPP-4阻害薬は高度肥満(BMI≧35 kg/m2)例だとA1c値低下作用が減弱するとの報告があります。 心不全例に浮腫や心不全リスク上昇と関連があるピオグリタゾンは推奨されません。また、スルホニル尿素はメトホルミンや他剤と、DPP-4阻害薬はプラセボと比較して心不全発症リスク上昇との関連が報告されているため、一部の欧米ガイドラインでは両薬剤の処方を避けるように勧告されています。
腎機能が高度に低下しeGFR<30ml/min/1.73m2となった場合、メトホルミンによる乳酸アシドーシス発症リスクが高まりますので投与中止が必要です。また、中程度腎機能低下の目安であるeGFR<45ml/min/1.73m2でもメトホルミンの長期処方は困難が予想されますので新規処方は控え他の薬剤を選択することを推奨します。イメグリミンの併用はeGFR<45ml/min/1.73m2での有効性/安全性が確立されていないため推奨できません。
注射製剤導入支援
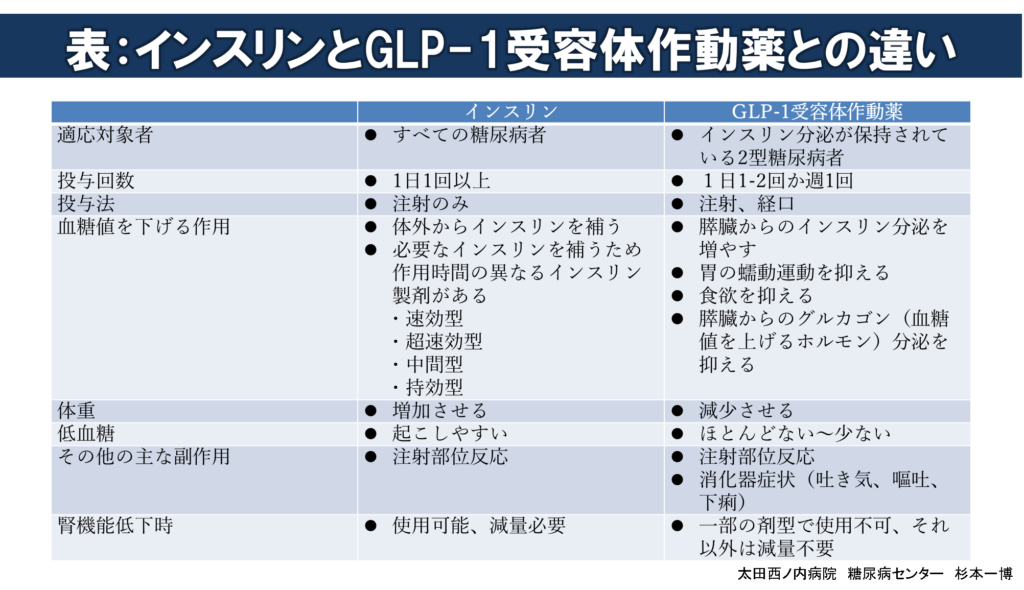
糖尿病の高血糖を改善するため処方される注射製剤には、インスリンとGLP-1受容体作動薬があります。
GLP-1受容体作動薬は比較的新しい注射製剤で、日本ではその1剤型が2010年6月11日から2型糖尿病の治療薬として処方可能となっています。その後、異なる剤型や週1回投与の剤型も順次処方可能となり、6種類(1日1~2回3剤型、週1回3剤型)の注射製剤に加え、2022年2月5日から経口薬も処方可能となっています(計7剤型)。
2010年まで注射製剤にはインスリンしかありませんでしたので、注射製剤=インスリンと思い込み、同じ注射製剤のGLP-1受容体作動薬もインスリンと間違って理解している方が(医療従事者でさえ)少なくありません。しかし、両者は同じ注射製剤でも血糖値を下げる作用や体に与える影響が全く異なります。
下表はインスリンとGLP-1受容体作動薬との違いをまとめたものです。
2剤形の持効型インスリン/GLP-1受容体作動薬固定比率配合製剤(IDegLiraとIGlarLixi)もそれぞれ、2019年9月26日と2020年6月6日から処方可能となっています。
2剤形の持効型インスリン/GLP-1受容体作動薬固定比率配合製剤(IDegLiraとIGlarLixi)もそれぞれ、2019年9月26日と2020年6月6日から処方可能となっています。
自己注射法
インスリンとGLP-1受容体作動薬(特に、週1回投与のGLP-1受容体作動薬)とでは、用量の調節の仕方や打ち方が異なりますので、正しく理解して使用することで副作用や低血糖を最小限にして効果を得ることができます。
注射部位と「インスリンボール」
インスリンとGLP-1受容体作動薬ともに腹部へ皮下注射します。ご自分でできない場合は、ご家族や介護者、あるいは週1回のGLP-1受容体作動薬はかかりつけ医でも実施する場合があります。
痩せている方や皮膚の弱い方があまり強く注射器を押しつけ過ぎると皮下出血の原因になったり、場合によっては筋肉注射になったりして、期待通りの効果得られないことがあります。
注射はお臍(へそ)の近くには打たないようにします。それ以外でも同じところにばかりに皮下注射していると、そのうち硬くしこり(硬結)のようになってしまいます。このしこり(硬結)は、1回に打つ用量の多いインスリン注射で起こることが多く、見た目がボールのように腫れ上がるため「インスリンボール」とも呼ばれています。
「インスリンボール」になった部位は、硬くなってあまり神経も通っていないため、注射による痛みを感じなくなります。痛み少なく楽なので、ついつい「インスリンボール」部位にばかり注射していたとお話しされる方も珍しくありません。
しかし、「インスリンボール」部位にインスリンを打っていると、インスリンを増やしても期待通りに効果が出にくくなり、用量がどんどん増えてしまいがちです。たくさんの量のインスリンをインスリンボールに打っていると更にインスリンボールが大きくなり、益々インスリンが効きにくくなると言う悪循環となります。
逆に、どんどん増量された大量のインスリンをたまたま「インスリンボール」部位以外に打ってしまうと、意識がなくなるほどの重症低血糖を起こして救急搬送に至る場合もあります。
いまは注射の針が改良され、痛みも大分少なくなり、痛みを理由に注射を中止される患者さんはほとんどいなくなりました。せっかく苦労して毎日打っている注射が期待通り効果を発揮しなかったり、低血糖を起こして救急搬送になったりしないためにも、正しい皮下注射法を必ず習得してください。
基礎インスリン導入法
基礎インスリン治療は空腹時血糖値が概ね180mg/dl、またはHbA1c値が概ね9%を超え、なおかつ他の治療(食事/運動/薬物療法)で数ヶ月以内には改善が見込めない方が主な対象になります。ただし、尿ケトン体が陽性となる場合は速やかな導入が推奨されます。
また、導入時にスルホニル尿素薬を処方中の場合、速やかに中止してください。
- 基礎インスリンとしては、通常作用時間が長く低血糖リスクの少ない持効型のインスリンアナログ製剤を用います。
- 初期投与量としては、通常現体重(kg)の0.05~0.1倍(単位)を1日1回腹部皮下注投与とします(例:体重60kgの場合、3~6単位を朝食前あるいは眠前投与など)。
- 自己血糖測定(SMBG)を導入し、必要に応じて空腹時SMBG値が<180mg/dlとなるまで3日ごとに1~2Uずつ増量します。
いったん高血糖が改善するとインスリン必要量が急激に減少する場合が多いため、以降は図5を参考にして投与量調節を行います。
図5:目標A1c値に応じた空腹時血糖管理
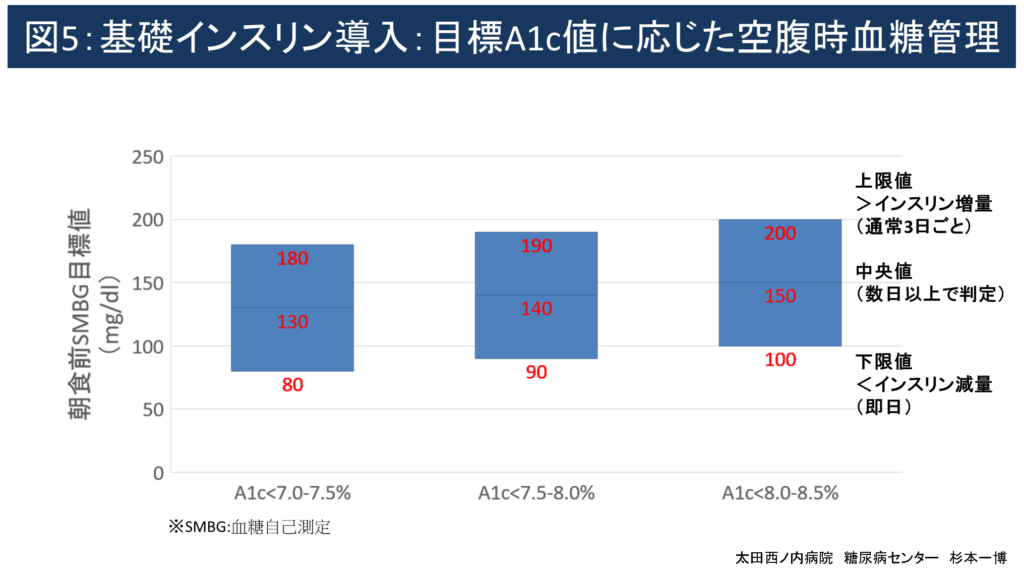
(1)個々の病状/病態に適した目標HbA1c(NGSP)値を設定します。
一般的に当センターで推奨する目標A1c値は以下のとおり各人の年齢や病状に応じて個別化しています
- 非高齢者/健康な高齢者:<7.0-7.5%
- 軽度認知機能/ADL低下高齢者:<7.5-8.0%
- 超高齢者または認知症含む重篤な併存症を有する者:<8.0-8.5%
※高血糖改善を目的に血糖低下作用の弱い(A1c値低下作用<-0.5%)薬剤を優先して選択することは一般に推奨されません。
注1)高齢者/超高齢者でも生命予後>10~20年が見込まれる場合、より厳格な目標空腹時血糖範囲/A1c値が考慮されます。
注2)夜間も含めた低血糖(<70mg/dl)、特に重症低血糖(<54mg/dl)は慢性高血糖より数年以内の生命予後の悪化と関連するため、低血糖回避を目標A1c値達成より優先し、場合によっては目標A1c値をより緩和します。
(2)2~3ヶ月間の空腹時自己血糖測定(SMBG)中央値が概ねA1c値に一致します。
- 空腹時SMBG中央値<130mg/dl=A1c値<7.0~7.5%
- 空腹時SMBG中央値<140mg/dl=A1c値<7.5~8.0%
- 空腹時SMBG中央値<150mg/dl=A1c値<8.0~8.5%
(※ただし食後血糖値が相対的に高いと空腹時SMBG値が目標に達してもA1c値が目標に達しない場合がある)
(3)目標A1c値を達成するための空腹時SMBG値の中央値、上限値、下限値目処を参照してください。
一般的に当センターで推奨する目標空腹時SMBG値範囲は以下の通りです。
(※血糖値の変動範囲は個々で大きく異なるため、以下は一定期間の下限値と中央値を目安として示します。目標範囲は実際の血糖変動や低血糖リスクの大きさに応じて適宜修正します。)
- 非高齢者/健康な高齢者:下限値≧80mg/dl、中央値<130mg/dl
- 軽度~高度認知機能障害/フレイル高齢者:下限値≧90~100mg/dl、中央値<140~150mg/dl
- 超高齢者または末期認知症含む重篤な併存症を有する者:最低値≧110mg/dl、中央値<180mg/dl
(4)空腹時SMBG値の上限/下限値は中央値±50mg/dlで設定してますが適宜調整してください。
- 例1(低血糖を避けたい若年長距離運転手など):
目標中央値130mg/dl±30mg/dl=上限値160mg、下限値100mg/dl - 例2(血糖変動が大きい健康高齢者など):
目標中央値140mg/dl±60mg/dl、上限値200mg、下限値80mg/dl
(5)上限値を超える場合:通常1日では判断せず連日または3日間のうち2日以上で1~2単位、または総投与量の約10%増量します。
(6)下限値を下回る場合:通常即日1~2単位、または総投与量の約10%減量します。
(7)長期的管理に移行したら、定期受診ごとに空腹時SMBG中央値を確認し、目標値になるようにインスリン投与量を±10%ほど調節しますが、低血糖/過剰治療防止のため目標下限値を下回らないことを優先してください。
- 例1:軽度認知障害高齢者で目標A1c8.0%に設定し目標空腹時SMBG中央値140~150mg/dlのところ、実際はA1c8.5%で空腹時SMBG中央値160mg/dl、しかし時々空腹時SMBG80mg/dl台も記録される場合→基礎インスリンは増量しない。この場合、上限値も時々超えているはずであり、血糖変動の原因を特定することを目指す(よくある原因:インスリン自己注射の問題、食習慣の問題、内因性インスリン分泌の高度低下など)。また、GLP-1受容体作動薬の併用/増量を検討する。
- 例2:若年者で目標A1c<7.0%に設定し目標空腹時SMBG中央値<130mg/dlのところ、実際はA1c7.5%で空腹時SMBG中央値140mg/dl、しかし時々空腹時SMBG70mg/dl台も記録される場合→下限値70mg/dl、上限値190mg/dlまで変動幅拡大も許容可能か相談/空腹時SMBG値が高値の日のみ基礎インスリン10%ほど増量を検討する。
(8)空腹時SMBG値が目標に達したにもかかわらずA1c値が目標値に達しない場合→食後血糖上昇を評価するため、持続血糖モニタリング導入を検討してください(初期から導入しておくと治療が遅滞なく行えます)。
基礎インスリン治療後の選択肢
基礎インスリン投与量調整により上記の目標空腹時SMBG値範囲を達成後にも目標A1c値を達成できない場合、追加インスリンまたはGLP-1受容体作動薬の併用が推奨されます。
図6:基礎インスリン治療後の選択肢
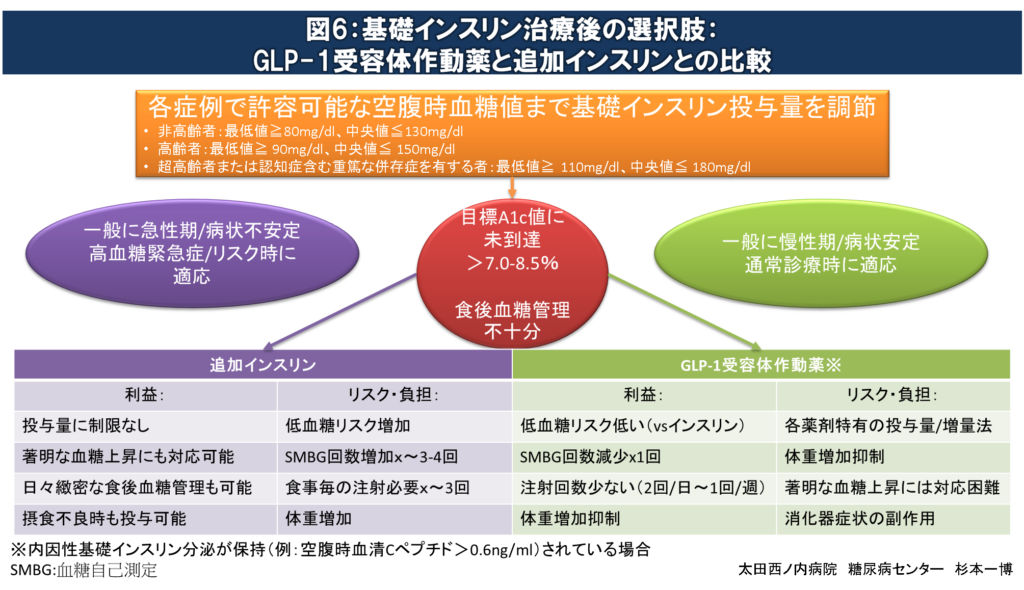
各人の空腹時血糖値が許容範囲に達したにもかかわらず目標A1c値に達しない場合、食後血糖管理が不十分であるとみなされます。
一般的に慢性期の病状が安定している症例には、低血糖リスクが低く必要な注射回数/自己血糖測定回数も少なく済むGLP-1受容体作動薬の併用が推奨されます。空腹時血糖値が180mg/dl未満にもかかわらず、A1c値が9%を超えている場合には食後高血糖の可能性が高く、基礎インスリンよりGLP-1受容体作動薬の処方が優先されます。しかし、GLP-1受容体作動薬には投与初期や増量時に嘔気、嘔吐、下痢、便秘など消化器副作用が1-2割ほど出現しますので適宜減量や中止が必要です。また、GLP-1受容体作動薬は内因性基礎インスリン分泌が保持されていない症例(例:空腹時血清Cペプチド<0.6ng/ml)では十分な効果が期待出来ない場合があります。
一方、急性期の著明な高血糖や病状の不安定な症例には追加インスリン(一般に食後血糖上昇抑制効果の強い超即効型インスリンアナログ製剤を推奨)を導入します。一旦追加インスリンを導入しても、病状が安定し急性期を脱したらGLP-1受容体作動薬への切り替えが推奨されます。内因性インスリン分泌が保持されている症例に漫然と追加インスリンを継続した場合、体重増加や低血糖リスクの上昇により生命予後の悪化と関連する可能性があります。
妊娠糖尿病(GDM)/糖尿病合併妊娠(PGDM)
初診時から出産まで一貫した方針で治療を継続できるよう、できるだけ担当医師は固定して皆様の厳格な血糖管理を支援します。
「妊娠糖尿病(GDM)」「糖尿病合併妊娠(PGDM)」とは・・・?
妊娠は受胎から出産まで母親の体の働きに大きな変化を及ぼします。
血糖値を調節する働きについても例外ではありません。特に、糖代謝への影響が目立つのは妊娠後期になります。正常妊娠においても、赤ちゃんや胎盤が急激に大きくなる妊娠20-24週になると血糖値を下げるインスリンという膵臓から分泌されるホルモンの働きが弱くなり(これを「インスリン抵抗性」と言います)、正常の血糖値を維持するためにより多くのインスリンが必要となります。
したがって、元々ある程度妊娠前にインスリン抵抗性があったりインスリンを分泌する膵臓の働きが弱かったりする場合、たとえ妊娠前には正常血糖値でも妊娠後期に血糖値が上昇して「妊娠糖尿病(GDM)」と診断される場合があります。
報告によって異なりますが、我が国では妊婦の約1割に「妊娠糖尿病」があると言われています。
また、すでに妊娠前から糖尿病と診断を受けている妊婦(「糖尿病合併妊娠(PGDM)」)では、妊娠後により血糖値がより上昇し、正常血糖値を維持するために妊娠前より多くのインスリンが必要となります。
血糖管理目標
受胎から出産まで母体と赤ちゃんに高血糖のよる影響が及ばないよう、可能な限り正常妊婦と同じような血糖値を維持することが求められています。
妊娠の予定がある場合、妊娠前から厳格な血糖管理を行うことが必要です(2-3ヶ月の平均血糖値を示すHbA1c値<6.5%が目安です)。
また、妊娠後においても、例えば米国産科婦人科学会や糖尿病学会では以下の様な厳格な目標血糖下限/上限値を示しています(ADA. Diabetes Care 2022; 45(Supplement 1): S223-S243より引用)。
また、日本糖尿病学会ガイドライン2019でも同様の血糖上限値が推奨されています。
| 下限(mg/dl)* | 上限(mg/dl) | |
|---|---|---|
| 空腹時 | 70 | 95 |
| 食後1時間 | 110 | 140 |
| 食後2時間 | 100 | 120 |
*目標下限値は正常妊婦の平均血糖値(Diabetes Care. 2011;34(7):1660-8)に基づいています。ただし、この下限値は食事療法のみの場合は適応せず、インスリン治療が行われている場合に適応します。
高血糖の影響と管理方針
母体の血糖値が高いと、母体では早産/流産、羊水過多症、帝王切開、妊娠高血圧症候群、糖尿病ケトアシドーシス、腎症や網膜症の悪化など、赤ちゃんでは先天異常、胎児死亡、巨大児、肩甲難産による分娩時外傷や新生児低血糖などの危険性が高くなることが報告されています。
一方、実際に母体の血糖値をどのくらい厳格に管理した方がより良いのか明確に示した研究はありません。
当センターでは新たな研究成果が示されるまで、生活習慣の改善とともに日本並びに米国糖尿病学会の推奨する上記表の下限/上限値を血糖管理目標として治療を行います。低血糖を起こさないよう注意しつつ、必要に応じて胎児への高い安全性が示されているインスリン製剤による治療を推奨します。
インスリン治療
上記治療方針でも記載したとおり、胎児への高い安全性が示されているインスリン製剤を用います。高い安全性が示されているインスリン製剤とは、ヒトインスリン製剤並びにランダム化比較試験でヒトインスリンと同等以上の安全性と有効性を示したインスリンアナログ製剤になります。
インスリンアナログ製剤とは、皮下投与した際により生理的なインスリン分泌に近い薬物動態を示すようにアミノ酸配列を修飾した製剤です。生理的なインスリン分泌には空腹時血糖値を一定に保つための基礎分泌と食後の血糖上昇を抑える追加分泌があります。基礎インスリン分泌を補うには中間型又は持効型インスリン製剤を用い、追加インスリン分泌を補うには速効型又は超速効型インスリン製剤を用います。
以下に米国産婦人科学会が示す妊娠中に一般的に使用されるインスリン製剤の作用をまとめます。
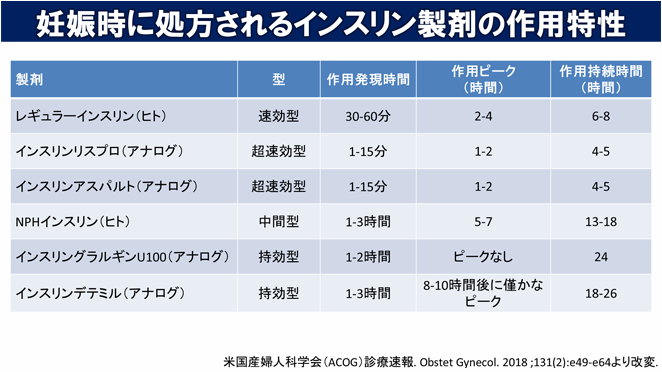
このうち、インスリングラルギンU100(アナログ)に関しては大規模なランダム化比較試験は行われていませんが、様々な試験を統合して解析した結果ではNPHインスリン(ヒト)に比べて周産期の合併症に差がないことが報告されています。
近年、より低血糖を起こしにくい他の持効型インスリンアナログ製剤についても妊娠時の安全性が報告されています。
当センターでは、最新の研究成果を含め各インスリン製剤の利点と欠点を総合的に評価し、皆様に十分な説明と同意をいただいた上で治療方針を決定しています。
自己血糖測定
インスリン治療を行う場合、自己血糖測定(SMBG)や持続血糖測定(CGM)を併用することでより良好な血糖管理を達成できる可能性が高まります。特に、1型糖尿病者では、妊娠前又は妊娠早期にCGMを併用することで、1日7回~のSMBGのみに比べてより母体のHbA1c値が低下し、新生児低血糖、新生児集中治療の時間が減少することが報告されています(CONCEPTT試験:Lancet. 2017;390(10110):2347-2359)。
また、CGMを併用することでSMBGのみでは気付きにくい睡眠中の低血糖の早期発見に繋がります。
当センターでは、1型糖尿病者のみならず、希望するすべてのインスリン治療中の皆様にCGMを活用した血糖管理を推進しています。
肥満症
福島県は小児・成人とも肥満率の高い県です。将来の生活習慣病の予防のために、体重を適正に保つことが重要です。
当院は日本肥満学会認定肥満症専門病院として、肥満予防外来(減量外来)を開設しております。
肥満とは・・・?
日本肥満学会では、肥満とは体格指数(BMI=体重/身長(m)×身長(m))が25以上、もしくは内臓脂肪(腹部CTにて100cm2以上)と定義し、特にBMIが35以上を高度肥満と定義しています。
さらに上記の肥満・高度肥満のなかで以下の11のいずれかの健康障害を合併した場合内臓脂肪蓄積(腹部CTで内臓脂肪面積100cm2)を医学的に減量の必要な病態としそれぞれ、肥満症・高度肥満症と定義します。
肥満症・高度肥満症の定義要因となる健康障害
- 糖尿病・耐糖能障害
- 高血圧
- 脂質異常症
- 脂肪肝・非アルコール性脂肪性肝炎
- 脳梗塞
- 心筋梗塞
- 高尿酸血症
- 睡眠時無呼吸群
- 関節疾患(変形性膝関節症他)
- 肥満関連腎臓病
- 婦人科系疾患(無月経など)
肥満症においてはメタボリックシンドロームの原因となる内臓脂肪蓄積に伴う肥満と、皮下脂肪蓄積に伴う肥満症があります。
肥満症の治療は減量です。下記の方法に基づき減量をしていきます。
- 食事療法
- 運動療法
- 認知行動療法
- 薬物療法
- 手術療法脂質異常症脂肪肝・非アルコール性脂肪性肝炎脳梗塞
減量の目標はまずは肥満症で現体重から3%(通常3~5kg)、高度肥満症は現体重から5~10%となりますが、個々の病態により目標体重は異なりますので、皆様一人ひとりと相談しながら減量方法・ゴールを共に考え減量していきます。
減量早期より糖尿病・耐糖能障害、高血圧、脂質異常症、高尿酸血症、脂肪肝に伴う肝機能障害などの病気の改善が期待できます。
巷にはいろいろなダイエットがありますが、減量のためには、長期的に継続できる、正しい知識の習得が必要です。
健康診断・職場健診で肥満を指摘されたら、早めに減量行動をすることが、将来の病気につながらない秘訣です。
低血糖症
低血糖症の原因として最も多いのが不適切な糖尿病治療や自己管理です。
その他にもアルコール大量摂取、飢餓状態(栄養失調)、胃切除後、インスリン抵抗性による食後の過剰インスリン分泌、インスリン産生腫瘍、副腎不全など様々な原因によっても低血糖が生じます。
当センターでは、必要に応じてこれらの鑑別診断*4を行い、望ましい治療や対処法を推奨します。
【用語説明】
*4鑑別診断:症状を引き起こしている疾患を絞り込むための診断
【文責】糖尿病センター 杉本 一博